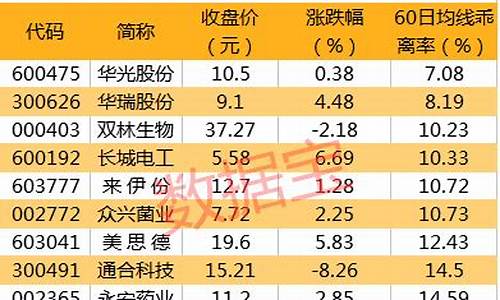
回收铅锑合金价格_铅锑合金价格走势
1.汽车电瓶问题
2.再生铅的再生方法
3.怎样处理废旧铅酸蓄电池?
4.手机电池上的两块芯片是什么芯片
汽车电瓶问题

1,汽车电瓶有干荷型和富液型,既非免维护和免维护。
2,现在,的电瓶寿命都不长,正常情况下24个月到36个月,要看用户自己的维护状况而定。
3,电瓶的更好与否不是按年限的,坏了,不存电了就要换新的。好的,能用的干嘛要换呢!
4,替换下来的旧电瓶大多车主直接以旧换新了,一般4S店换的话,他们不收旧的,所以旧电瓶就卖给回收电瓶的商贩或者废品回收站。建议车主们在汽车电瓶专卖店换。我卖电瓶的,负责任的告诉你,4S店里的电瓶价格是翻了倍的。
再生铅的再生方法
(1)火法冶金工艺
火法冶金工艺又分为无预处理混炼,无预处理单独冶炼和预处理单独冶炼三种工艺。铅蓄电池经去壳倒酸等简单处理后,进行火法混合冶炼合金。该工艺金属回收率平均在8500^9000,废酸、塑料元素未得到合理利用,而且污染比较严重。无预处理单独是废铅蓄电池经破碎分拣后分出金属部分和铅膏部分,两进行火法冶炼,得到铅锑合金和精铅,该工艺金属回收率
平为9000^-9500,而且污染控制较第一类工艺有较大改预处理单独冶炼工艺就是废铅蓄电池经破碎分选后分出金和铅膏部分,铅膏部分脱硫转化,然后两者再分别进行火炼,得到铅锑合金和软铅,该工艺金属回收率平均为95 0o艇如德国的布劳巴赫厂金属回收率达到98. 5 0 o。我国“间曾对无污染再生铅技术进行科技攻关,掌握了先进的再产技术,并建成了三个无污染再生铅示范厂。这些先进的再采用M. A破碎分选技术,但在脱硫方案及脱硫剂选择、
技术条件、燃烧技术、加料系统等方面做了较大的改革,适合我国国情。
(2)固相电解还原工艺
固相电解还原是一种新型的炼方法,采用此方法金属铅的回收率比传统炉火熔炼法高出右,生产规模可视回收量多少决定,可大可小,因此便于推于供电资源丰富的地区就更容易推广。该工艺是把各种铅的放置在阴极上进行电解,正离子型铅离子得到电子被还原铅。其设备采用立式电极电解装置。其工艺流程为:废铅污相电解~熔化铸锭一金属铅。每生产一吨铅耗电约700kW收可达95%以上,回收铅的纯度可达99. 95 0 o直接利用矿石冶炼铅的成本。
(3)湿法冶炼工艺采用湿法冶炼工艺,
产品成本大可使用铅泥、生产含铅化工产品,如三盐基硫酸铅、丹和硬脂酸铅等,可在化工和加工行业得到应用。
怎样处理废旧铅酸蓄电池?
1、对废旧电池进行加工处理,提炼里面有价值的金属。
2、电动车普遍使用的电池为铅酸电池,属于易耗品,品牌电池的使用期限为1-2年,尽管铅酸电池已被列入国家危险废物名录,但是没有规定实行强制回收。对废旧电池的回收处理属于高成本重污染的回收加工业,受技术和条件的限制,目前只是对废旧电池进行回收封存,以防止污染环境。一些炼铅小作坊和废品收购站收购这些废旧铅酸电池,他们不具备处理加工条件,在提取完有价值的金属后,随意倾倒,会严重污染环境。废旧电池或处理电池留下的残渣残液进入水体里,造成水环境的重金属污染;随意倾倒在地表,有可能对土壤环境污染,进而影响生长的植物。
手机电池上的两块芯片是什么芯片
个人估计:
大块的是限制电压的作用,最高承受20V的电压,充电器一般使用5V的电压,劣质的电压不稳定,高时会达到10V左右,估计是电池的保护线路
小块的是限制电流用,最高承受6A的电流,一般充电器是2A的电流,劣质充电器电流不稳定,发热时电流会增加到3A左右
电池最基本的原理是,电充进去,使用时负极向正极放电,电进入使用的电器把能量消耗,由回路再到电池中带电去电器中消耗,简单来说就是这样
如果要详细的内容,那资料太多,参考以下在网络论坛中搜索到的资料,资料也是转载未标明来源,估计是在电子相关的书上取得的
:::::::::::::::::::::::::::::
电能是现代社会生活的必需品,电能是最重要的二次能源,大部分的煤和石油制品作为一次能源用于发电。煤或油在燃烧过程中释放能量,加热蒸汽,推动电机发电。煤(或油)燃烧过程就是它和氧气发生化学变化的过程,所以“燃煤发电”实质是化学能?机械能?电能的过程,这种过程通常要靠火力发电厂的汽轮机和发电机来完成。另外一种把化学能直接转化为电能的装置,统称化学电池或化学电源。如收音机、手电筒、照相机上用的干电池,汽车发动机用的蓄电池,钟表上用的钮扣电池等都是小巧玲珑携带方便的日常用品。那末哪些化学体系可以设计成为实用的电池呢?
化学电池都与氧化还原反应有关。在18世纪末,人们把与氧化合的反应叫氧化反应,而把从氧化物中夺取氧的反应叫还原反应。到19世纪中叶,有了化合价的概念,人们把化合价升高的过程叫氧化,把化合价降低的过程叫还原。20世纪初建立了化合价的电子理论,人们把失电子的过程叫氧化,得电子的过程叫还原。例如:
这两个式子分别代表两个氧化还原半反应,两个半反应组合成一个氧化还原反应:
上式代表锌片和硫酸铜溶液发生置换反应生成硫酸锌和金属铜的离子反应方程式。反应过程中电子由Zn转移给Cu2+,Zn失去电子被氧化为Zn2+,Zn本身是还原剂,它使Cu2+还原为Cu,所以Cu2+本身则是氧化剂。有失电子的一方,就有得电子的一方,电子得与失一定同时发生,即氧化与还原一定同时发生。
凡涉及电子转移的反应都属于氧化还原反应,若这些电子能顺一定方向流动便成为电流。按图2—10所示,左边烧杯里盛硫酸锌溶液,并插入锌片,右边烧杯里盛硫酸铜溶液,并插入铜片;两个烧杯之间用“盐桥”相联。(盐桥是一个盛KCl饱和溶液胶冻的U形管,用以构成电子流的通路)。锌片和铜片之间用电线相联结,中间串联一个电压表(或电流表),电表指针的偏转证明上述装置确有电流产生,这就成为由锌电极(Zn—ZnSO4)和铜电极(Cu-CuSO4)组成的一个电池,简称锌-铜电池。在这个装置里,锌片并没有和CuSO4溶液相接触,但确实可以看到在锌极发生的是Zn片溶解生成 Zn2+,在铜极则有Cu2+还原成金属铜析出在铜片上,电子由锌极流向铜极,电流方向反之,即由铜极流向锌极,电流表指针向正方向偏转指明铜极为正极,锌极为负极。两个电极反应分别是:
正极:Cu2+ + 2e- ? Cu
负极: Zn ? Zn2+ + 2e-
若 Zn2+和 Cu2+的浓度都是 1.0 mol×L-1,用高阻抗伏特计测得两极电势差为1.1V,即该电池的电动势为1.1V。若用铁片和硫酸亚铁溶液代替上述锌电极,则组成铁-铜电池。当Fe2+和Cu2+浓度都是1.0 mol. L-1时,测得电动势为0.75V。若以Ag和AgNO3溶液(1.0 mol×L-1)代替铜电极,组成了锌-银电池,其电动势则为1.6V。与上述电池相关的氧化还原反应,电子流动方向和电池电动势(E)如下:
这几个反应是读者熟悉的金属置换反应,按图2-10所示原理可以装成经典的化学电池,在上个世纪它们曾是实用的化学电源。
电池的电动势决定于电极得失电子的能力和溶液的浓度。电极得失电子的能力,用“电极电势”表示,它是一类相对数据,表2-6列举了一些手册里记载的水溶液中的标准电极电势Eq。其中“标准”两字是指电极反应中的物质都处于标准状态,即溶液中离子浓度都是 lmol×L-1,气态物质的分压都是 100 kPa,温度为 298K(25℃)。以氢电极作为比较的标准,指定氢电极的标准电极电势为零:
2H+(1.0 mol×L-1)+ 2e-? H2(100kPa)
其他电极与之相比,如,表示铜电极电势比氢电极高0.34V;而= -0.76V,表示锌电极电势比氢电极低 0.76 V。由此可以求得铜电极电势比锌电极高1.10 V,即锌-铜电池的电动势为 1.10 V。
利用表2-6数据,还可以判别水溶液中氧化还原反应的方向。电极反应物质有氧化态与还原态,在书写反应方程式时,氧化态物质写在左边,得电子变为还原态,还原态物质写在右边。电极反应的Eq值越大,表示氧化态物质得电子能力越大,即氧化能力越大。
如表里左下方的氧化态物质F2,Cl2。,S2O82-,MnO4-等都是很强的氧化剂。反之Eq值越小,氧化态得电子能力越小或还原态失电子能力越大,亦即右上方还原态物质如 K,Na,Zn等都是强还原剂。由此可知表中左下方的氧化态物质可以和右上方的还原在物质起反应;反之右下方的还原衣物质不能和左上方氧化态物质起反应。例如 H+和 Fe可以起反应生成H2和Fe2+,而H+不能和Ag起反应,此即铁能和酸起置换反应放出H2,而银不能和酸起反应。同理,可以判断Cl2能氧化Br-或I-,但Fe3+只能使I-变为I2,而不能使Br-变为Br2。化学手册里有许多常见物质的有关Eq值可供参考。
任何两个电极反应都可组成一个氧化还原反应,理论上都可以设计成一个电池,但真要做成一个有实际应用价值的电池并非易事。目前我们最熟悉而又经常使用的莫过于锌-锰干电池和铅蓄电池。
2 锌-锰干电池的工作原理
以上列举的几种电池有溶液,便于说明原理,但不便于携带。日常用的收音机,手电筒里使用的都是干电池,其电压一般为1.5V,电容量随体积大小而异(分1号,2号,3号,4号,5号等)。外壳用锌皮作为负极,中心为正极,是一根导电性能良好的石墨棒,裹上了一层由 MnO2,炭黑及NH4Cl溶液混合压紧的团块。两个电极之间的电解液是由NH4Cl,ZnCl2,淀粉和一定量水组成,将其加热调制成浆糊并趁热灌入锌筒,冷却后成半透明的胶冻不再流动,但可以导电。锌筒上口加沥青密封,防止电解液渗出。锌-锰干电池的电极反应为
锌负极: Zn+4NH4Cl?(NH4)2ZnCl4+2NH4++2e-
锰正极: MnO2+H2O+e-?MnO(OH)+OH-
在使用过程中,电子由锌极流向锰极(电流方向相反),锌皮逐渐消耗,MnO2也不断被还原,电压慢慢降低,最后电池失效。这种电池是一次性消费品,但锌皮不可能完全消耗掉,所以旧电池可回收锌。锌既然是消耗性的外壳,在使用过程中就会变薄以致穿孔,这就要求在锌皮外加有密封包装,有些劣质产品,在使用过程中发生“渗漏”现象,即是没有按要求做的缘故。
3 铅蓄电池的工作原理
电池放电到一定程度,可以利用外电源进行充电后再用,这样充电放电可以反复几百次。汽车的启动电源常用铅蓄电池,其结构如图2-12所示。
电池内有一排铅锑合金的栅格板,栅孔为细的铅粉泥所填满。栅板交替由两块导板相联,分别成为顶部的两个电极。整个电极板在使用之前先浸泡在稀硫酸溶液中进行电解处理,在阳极,Pb被氧化成为二氧化铅(PbO2),在阴极,形成海绵状金属铅。干燥后,PbO2为蓄电池的正极,海绵状铅为负极。所用电解液为 30%的硫酸(H2SO4),因此这类电池可以也叫酸性蓄电池。放电时,电极反应和电池反应如下:
正极: PbO2 + 2H2O ? PbO2 + SO42- + 4H+ + 2e-
负极: PbSO4 + 2e- ? Pb + SO42-
放电反应:PbO2 + Pb + 2H2SO4 ? 2PbSO4 + 2H2O
放电之后,正负两极都生成了一层硫酸铅(PbSO4),到一定程度就必须充电。充电时是将一个电压略高于蓄电池的直流电源与它相接, PbO2电极上的PbSO4放出电子被氧化为PbO2,Pb极上的PbSO4接受电子被还原为Pb,于是蓄电池的电极恢复原状,又可放电。充电时的电极反应和电池反应恰好是放电时的逆反应:
PbO2极:PbSO4 + 2H2O ?PbO2 + SO42- + 4H+ + 2e-
Pb极: PbSO4 + 2e- ?Pb + SO42-
充电反应:2PbSO4 + 2H2O ?PbO2 + Pb + 2H2SO4
铅蓄电池放电和充电过程可以合并写为
铅蓄电池每个单元电压为2.0V左右,汽车用的电瓶一般由3个单元组成,即工作电压在6.0V左右。若电容量为几十至一百安培,放电时,单元电压降到 1.8V,就不能继续使用,必须进行充电。只要按规定及时充电,使用得当,一个电池可以充放电300多次,否则使用寿命会大大降低。这种蓄电池具有电动势高、电压稳定、使用温度范围宽、原料丰富、价格便宜等优点。主要缺点是笨重、防震性差、易溢出酸雾、维护不便、携带不便等。针对这些问题,科技工作者认真不断地从电极材料、隔板材料、电解液组成、电池槽体、整体密封等多方面进行改进。自80年代以来各种新型的铅蓄电池逐渐问世,它们在汽车工业、通讯业、飞机、船舶、矿山、军工等方面都有广泛应用。在当今各种电池中,就其总产量而言,铅蓄电池还是占90%。
4 其它常见的几种电池
新技术的发展,迫切要求研制体积小、质量轻容量大、保存时间长的各种新型化学电源。现在已经商品化的电池有以下几种。
碱性蓄电池 日常生活中用的充电电池就属于这类。它的体积、电压都和干电池差不多,携带方便,使用寿命比铅蓄电池长得多,使用恰当可以反复充放电上千次,但价格比较贵。商品电池中有镍-镉(Ni—Cd)和镍-铁(Ni-Fe)两类,它们的电池反应是
反应是在碱性条件下进行的,所以叫碱性蓄电池。
银-锌电池 电子手表、液晶显示的计算器或一个小型的助听器等所需电流是微安或毫安级的,它们所用的电池体积很小,有“钮扣”电池之称。它们的电极材料是Ag2O2和Zn,所以叫银-锌电池。电极反应和电池反应是:
负极:2Zn + 4OH- ? 2Zn(OH)2 + 4e-
正极:Ag2O2 + 2H2O + 4e- ? 2Ag + 4OH-
电池反应:2Zn + Ag2O2 + 2H2O ? 2Zn(OH)2 + 2Ag
利用上述化学反应也可以制作大电流的电池,它具有质量轻、体积小等优点。这类电池已用于宇航、火箭、潜艇等方面。
燃料电池 氢气(H2),甲烷气(CH4),乙醇(C2H5OH)等物质在氧气(O2)中燃烧时,能将化学能直接转化为电能,这种装置叫燃料电池。这些气体分子
首先在电极催化剂的作用下离子化,再与 O2起反应生成 CO2和 H2O。这种电池能量利用率可高达80%(一般柴油发电机只有40%左右),反应产物的污染也少。一种 10~20 kW的碱性 H2—O2燃料电池已成功地用于航天飞机,在美国、日本还有若干示范性的CH4-O2燃料电池发电站,但目前这类电极成本很高,气体净化要求也高,短期内难于普及。
此外,银-锰电池、锂-碘电池、钠-硫电池、太阳能电池等多种高效、安全、价廉的电池都在研究之中。化学电源的研究和开发是化学科学的重要研究领域之一,也是能源工作者研究领域之一。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。